
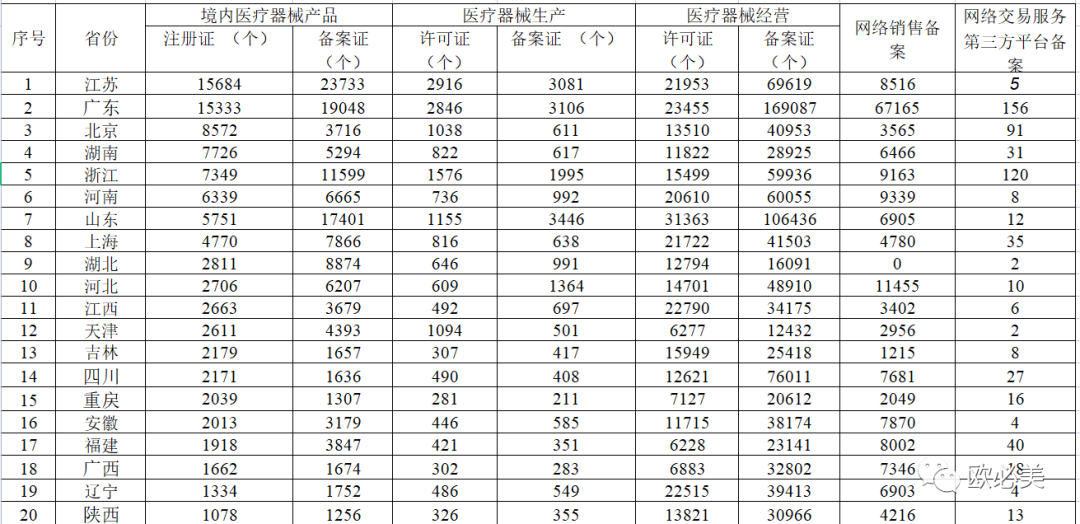
400-0569-812
巴西篇 ANVISA – 3 月 30 日发布:RDC No 665,为医疗产品和体外诊断产品提供良好生产规范。新的RDC 665 2022取代了RDC
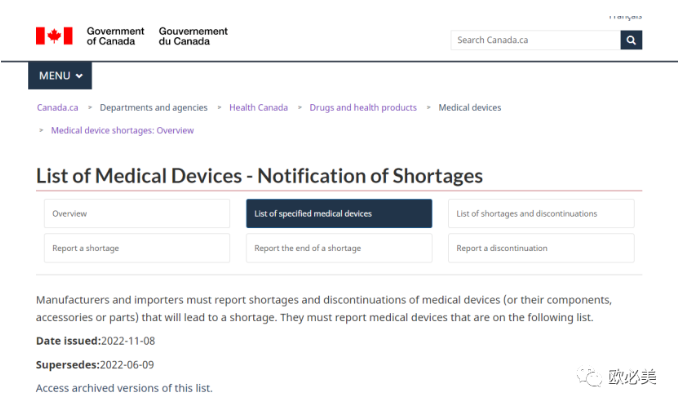
FDA和加拿大卫生部正在进行联合试验。试点将测试向FDA和加拿大卫生部提交的单一eSTAR的使用情况。使用eSTAR的可行性将由9名参与者的试

2022年12月6日,从欧洲传来医疗器械新法规MDR关于MDD过渡期延期的提案。提案就(EU)2017 745法规第120条(过渡性条款)对于持

新冠自测2022年5月的IVDR新规实施之前,IVDD时代落幕之际,波兰两家公告机构 PCBC(CE 1434)和CeCert(CE 1434) 一口气为
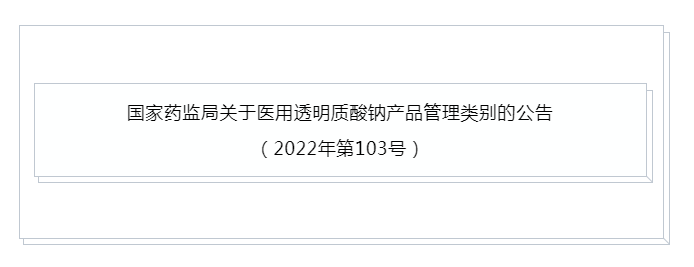
为加强医用透明质酸钠(玻璃酸钠)产品的监督管理,进一步规范相关产品注册(备案),保证公众用药用械安全有效,根据《药品管理法》《医疗

上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1