
400-0569-812
在产品开发过程中,需依照ISO14971(等同YY/T 0316-2016)进行风险管理。
培训回顾:本次郝老师分为三个主题依次来讨论:1,研发过程中的设计验证;2,风险管理在设计验证中的应用;3,医疗器械产品常见设计验证项。
考虑到不同医疗器械产品的巨大差异,目前,所有医疗器械法规对设计开发阶段划分并无具体强制要求,而是由企业依据产品复杂程度、企业状况进行定义。
如设计开发过程瀑布图
(Waterfall Design Process, HC/FDA):
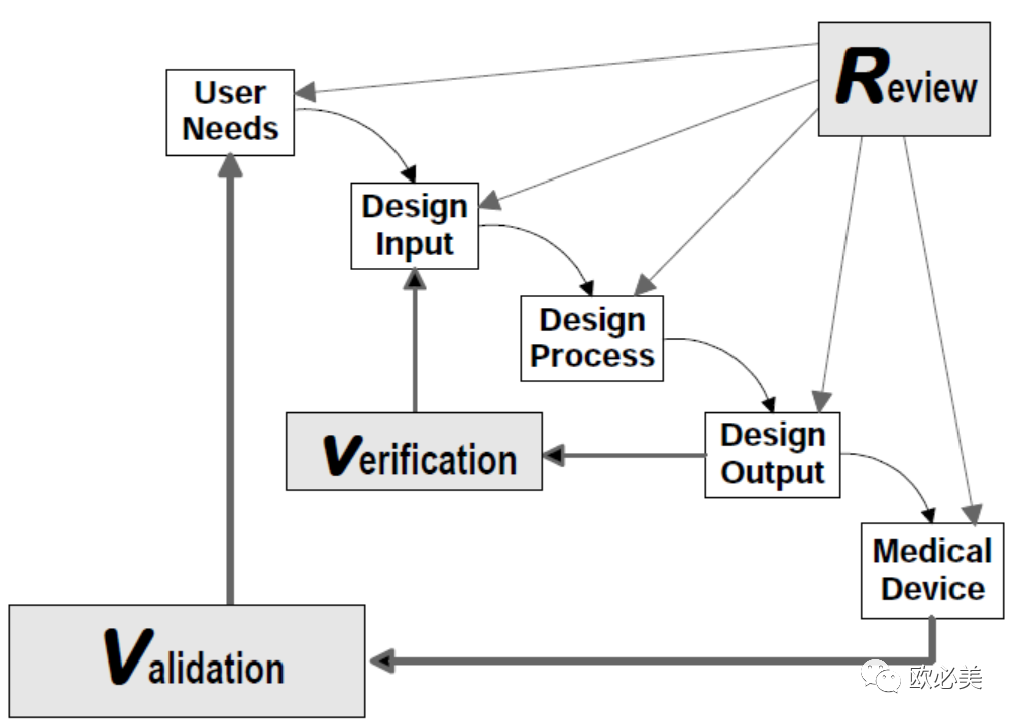
为设计阶段的“设计验证”,是研发流程中核心节点,通常采用试生产(中试)产品实施产品各项性能和功能验证。这些验证报告亦作为产品临床前评价证据。
上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1