
400-0569-812
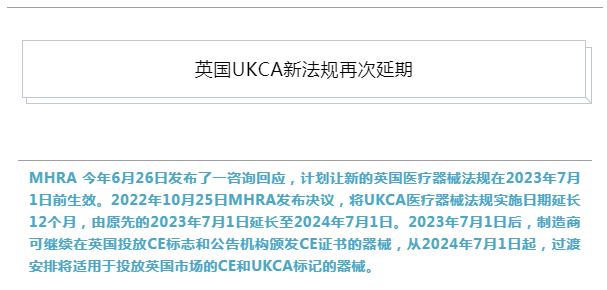
现行的医疗器械法规(UK MDR 2002)规定,英国市场对CE标志器械的接受将于2023年6月30日结束。这一点现已改变。政府响应中所述的过渡安排概述了对英国市场上的CE认证医疗器械的认可范围的扩展,一旦修订,将反映在2002年英国MDR中。
政府计划在2023年春季之前出台立法,使政府回应中概述的过渡安排和上市后监管要求生效。在更广泛的未来监管制度之前实施新的上市后监管要求,反映了政府将改善患者安全作为未来医疗器械法规的一部分的优先事项。
2023年7月1日之后,制造商将能够继续在英国市场投放CE标记的设备。从2024年7月起,过渡安排将适用于投放英国市场的CE和UKCA标记的设备。
根据世界贸易组织(WTO)技术性贸易壁垒协定,国务卿将被要求分享未来医疗器械制度的法规草案,以征求意见。在条例提交议会之前,评论期必须至少持续60天。条例草案将由世贸组织公布,并将为MHRA所有主要利益攸关方提供机会,在法律草案生效之前对其进行审查和评论。
英国医疗器械监管指南将进行修订,以反映新的医疗器械法规实施的延长时间表。
该立法将附有指导,以支持开发商解释新法规。在整个创新生命周期的现有专家组的基础上,并与患者和行业重点小组合作,MHRA将从今年开始举办一系列研讨会,以完善MHRA的思维并支持新制度的实施。
还是再次强调,这些转换期是针对老产品的,因此新法规中很可能会规定,在转换期内,产品不能有重大变更,以及要符合新的上市后监督(PMS)的要求。
上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1