
400-0569-812

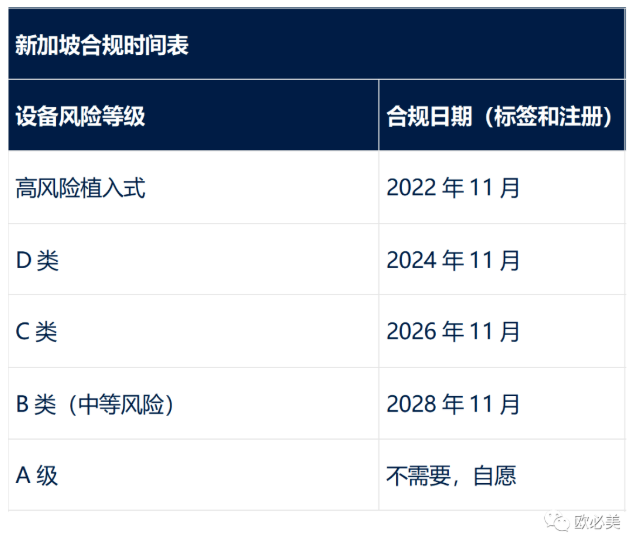
新加坡还允许企业在以下列出的截止日期前,对进口的医疗器械给予6个月的宽限期。因此,例如,一家拥有高风险植入式设备的公司,要求在2022年11月进行UDI标记和注册,则可以在2023年5月1日之前继续销售不符合UDI标准的设备(允许在合规日期之前耗尽当地库存)。
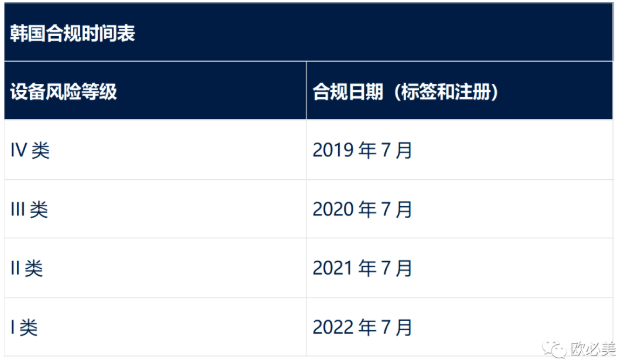
请注意,韩国法规中提到的是“综合医疗器械信息系统”,即IMDIS(即UDI数据库);以及“医疗器械标准代码”,即UDI代码本身。
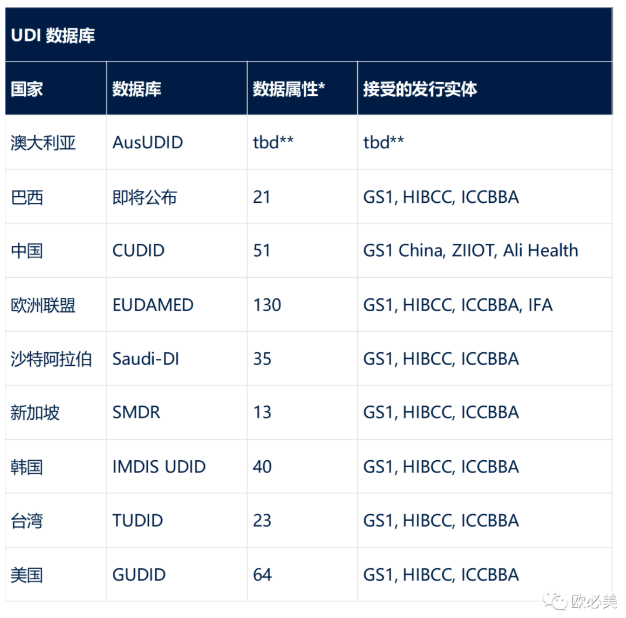
此外,各国要求UDI-DI信息由“发布实体”提供。请注意,所有国家均接受GS1作为发布实体。
上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1