
400-0569-812
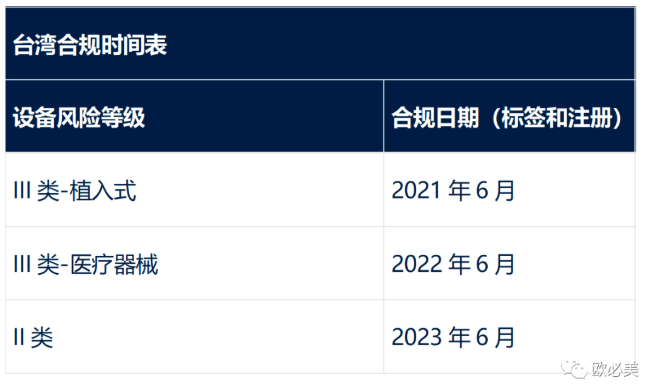
在合规日期之前进口的医疗器械可以在不满足UDI要求的情况下,在合规日期后的1年内进行分销。此例外不适用于直接标记(DM)要求,即设备本身上UDI的永久标记。
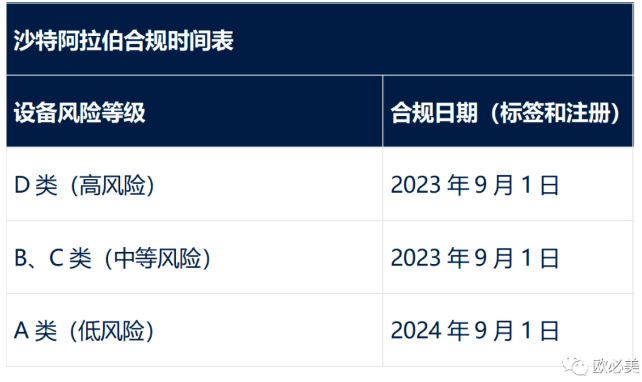
所有UDI要求:
· D类设备——沙特-D准备就绪1年后
· B/C类设备——沙特-D准备就绪2年后
· A级设备——沙特-D准备就绪3年后
· 对于直接标记要求-适用类别合规日期后2年

上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1