
400-0569-812
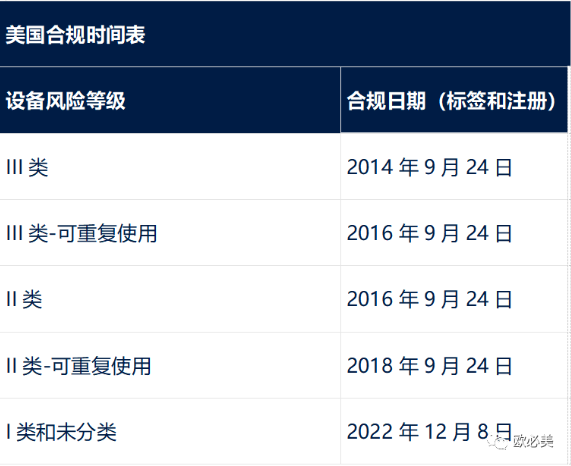
美国目前要求所有设备都符合标签和数据库要求。食品和药物管理局不打算在2022年12月8日之前对I类和非分类设备(植入式、支持生命或维持生命的设备(I/LS/LS)除外)实施GUDID提交要求,无论其是否为消费健康产品。美国食品和药物管理局要求所有的UDI信息都必须输入美国特定的GUDID数据库。
美国合规时间表
UDI数据录入欧盟UDI模块的强制性合规预计在2026年年中要求完成。
UDI标签的第一个合规截止日期是2022年5月26日,其他设备类别将在2027年5月26日之前推出。


UDI数据库的详细信息以及相关的合规日期尚不可用。

*2022年1月,随着这项法规的实施,UDI标签在冠状动脉支架、药物洗脱冠状动脉支架以及髋关节和膝关节置换术中的植入物上成为强制性的。
有关详细信息,请参见ANVISA UDI指南。
5
加拿大UDI要求:
加拿大卫生部已经提出了一个UDI框架,它紧密地基于国际来自IMDRF的UDI指南。目前的提案要求所有设备都贴上UDI标签,I类低风险设备除外。加拿大卫生部打算开发一个UDI数据库,或者修改现有的医疗设备活动许可证列表数据库(MDALL)以容纳UDI数据。预计与大多数国家一样,加拿大将根据需要添加少量额外的UDI数据属性。
上海欧必美医疗技术集团有限公司 版权所有 Copyright© 2022-2026 All rights reserved 沪ICP备19022935号-1